Trabajo Final Seminario Facultativo Disciplinar (I)
Profesorado de Física. I.E.S. N° 2 "Mariano Acosta"
Profesorado de Física. I.E.S. N° 2 "Mariano Acosta"
Espectros Estelares
Profesor:
Carlos Trapani
Alumno:
Alejandro Lavagnino
Diciembre
de 2009
Índice
Introducción ....................................................................................................
3
Historia del origen de los espectros.
Fraunhofer, Kirchhoff y Bunsen. .......... 3
La Radiación: una primera
aproximación...................................................... 7
Espectros de emisión
...................................................................................
11
Espectros de absorción
................................................................................
12
Temperatura y clasificación de las estrellas
................................................. 12
Temperatura de color
...................................................................................
15
Distancias
estelares......................................................................................
16
Velocidad......................................................................................................
17
Rotación........................................................................................................
18
Composición química superficial
.................................................................. 19
Bibliografía....................................................................................................
20
Espectros
Estelares
Alejandro Lavagnino
Introducción
El cielo siempre fue para la humanidad objeto de curiosidad, de culto y de estudio, y, por ende, también lo fueron los elementos que lo constituyen y sus movimientos. Y lo que más llama la atención al mirar un cielo nocturno son esos puntitos luminosos, desparramados aparentemente al azar, con variedad de brillo y color y con movimiento, por lo general, lento e irrevocable.
Durante toda la historia se ha querido saber qué son y de qué están hechos esos puntitos y han surgido diversas ideas y teorías acerca de ellos, producto de la imaginación de cada observador con sólo obtener la información luminosa que les llegaba. El siglo XX propició las condiciones necesarias para recopilar la mayor cantidad de información acerca de las estrellas de toda la historia, gracias al desarrollo de la teoría electromagnética y a su aplicación a lo percibible desde el espacio exterior.
Este trabajo pretende explicar las características más importantes de las estrellas, a la luz de las teorías que se desarrollaron desde fines del siglo XIX y durante el siglo XX, y de las tecnologías que las acompañaron, ya que a mí, como a muchos seres humanos, me atrae con especial interés saber de qué está hecho ese universo que se nos aparece en forma de cielo y las ideas con que los hombres imaginan y fundamentan su composición.
En cuanto a la utilidad del tema considero esta división:
Científica
• calculo de la masa total del universo
• calculo del tamaño del universo
• calculo de la velocidad de expansión
• teoría de la materia oscura y otras formas de energía
Personal
• Entender más profundamente los fenómenos subatómicos
explicados por
la mecánica cuántica y sus efectos macroscópicos.
En cuanto a su factibilidad, el tema comenzó a desarrollarse a fines del siglo XIX y continuó durante el siglo XX, por lo que hay mucha bibliografía accesible al respecto. Es la base de la actual física teórica aplicada a la astronomía, por lo que se encuentra en continuo crecimiento.
En cuanto a su factibilidad, el tema comenzó a desarrollarse a fines del siglo XIX y continuó durante el siglo XX, por lo que hay mucha bibliografía accesible al respecto. Es la base de la actual física teórica aplicada a la astronomía, por lo que se encuentra en continuo crecimiento.
Historia del origen de los
espectros. Fraunhofer, Kirchhoff y Bunsen.
En
1814 Joseph Fraunhofer (1787 – 1826)
estudiaba el comportamiento de la luz
utilizando un prisma de calidad excepcional; examinando la descomposición de
la luz hecha por el prisma, mediante el telescopio de un teodolito notó que el espectro
solar (el arcoiris de colores) estaba interrumpido por líneas oscuras, zonas
donde la intensidad de la luz es notoriamente menor.
Fraunhofer
no era el primero en notar las líneas oscuras del espectro solar. El químico
inglés William Hyde Wollaston (1766–1828) había
repetido el experimento
de Newton de descomposición de la luz solar en un prisma pero había
reemplazado el orificio de entrada de luz al prisma por una delgada ranura,
de tan sólo 1 milímetro. El espectro solar, ahora con una menor superposición
entre los colores, le mostró siete líneas oscuras. Wollaston publicó
sus resultados en un artículo en las “Philosophical
Transactions” de
la Royal
Society en 1802. Wollaston las interpretó como líneas divisorias que separan
un color de otro o un matiz de otro y no les atribuyó importancia alguna.
Fraunhofer
sin embargo dedicó a ellas toda su atención. Contó primero 354 y luego,
con un telescopio más poderoso, 700 líneas, designando a las más prominentes
con las letras del alfabeto: A, B, C, D, etc. desde el rojo hacia el azul,
creando de este modo las bases de una nomenclatura que sus sucesores no
tuvieron más que ampliar. Reconoció que a cada línea corresponde una posición
exactamente determinada y al examinarlas con distintas posiciones del
aparato y distintas posiciones del Sol se dio cuenta de que no se movían con
respecto a los colores y que eran inherentes a la fuente de luz, en este caso
el Sol.
A
partir de ese momento el interés de Fraunhofer por las líneas oscuras del espectro
solar fue aún mayor. Descompuso en su prisma la luz de la Luna y de Venus,
comprobando que están presentes las mismas líneas oscuras que en el espectro
solar. Observó también diversas estrellas; algunas, como Capela, reproducen
débilmente el espectro solar mientras otras tienen diseños de líneas
oscuras totalmente distintos. Esto lo explica en memorias escritas en 1814
y 1815. En otra serie de observaciones reemplaza el prisma por placas de cristal
sobre la cual ha trazado líneas muy próximas entre sí, hasta 300 por milímetro.
Estas “redes de difracción” le permiten medir
la longitud de ondas de las
líneas oscuras del espectro con una exactitud tal que sus errores son menores
al uno por mil.
Fraunhofer
no se limitó a observar fuentes luminosas celestes; las llamas de las
bujías y lámparas de aceite le ofrecen espectros continuos sin líneas. Introdujo
sal común en una llama lo que hacía aparecer una intensa línea amarilla,
en emisión, que al ser observada con mayor resolución resultó ser una
línea doble. Esta intensa línea amarilla de la llama hacía sido descubierta a mediados
del siglo XVIII por un joven físico escocés Thomas
Melville (1726 - 1753),
quien murió en 1753 a la temprana edad de 27 años. Desgraciadamente Melville
publicó su descubrimiento en una oscura colección de ensayos que nadie
prestó atención.
Fraunhofer la buscó en el espectro solar y estaba exactamente en el mismo lugar donde hay dos líneas negras (oscuras) que había llamado línea D. Lamentablemente no reparó en la coincidencia ni supo interpretarla. Utilizó las líneas para medir índices de refracción de diversos cristales. Con mejores valores para los índices de refracción de cristales Fraunhofer diseñó y construyó los mejores refractores de la primera mitad del siglo XIX. Por décadas “un refractor de Fraunhofer” fue sinónimo de un excelente telescopio, tanto en su óptica como en su mecánica.
Fraunhofer la buscó en el espectro solar y estaba exactamente en el mismo lugar donde hay dos líneas negras (oscuras) que había llamado línea D. Lamentablemente no reparó en la coincidencia ni supo interpretarla. Utilizó las líneas para medir índices de refracción de diversos cristales. Con mejores valores para los índices de refracción de cristales Fraunhofer diseñó y construyó los mejores refractores de la primera mitad del siglo XIX. Por décadas “un refractor de Fraunhofer” fue sinónimo de un excelente telescopio, tanto en su óptica como en su mecánica.
Julius Plücker (1801-1868),
obtuvo los espectros de varios gases mediante descargas
eléctricas en tubos de vacío reconociendo que el espectro es una característica
fija del gas que lo engendra. Sin embargo Plücker se limitó a comprobar
este promisorio resultado sin intentar desarrollarlo.
El
químico Robert Wilhelm Bunsen (1811–1899)
experimentador tan lleno de inventiva
como incansable y el brillante teórico Gustav
Kirchhoff (1824–1887), ambos
profesores de la Universidad de Heidelberg, se complementaron en una gran
colaboración. Las llamas coloreadas por ciertas sustancias atrajeron la atención
de Bunsen que se esforzó en obtener de ellas un medio seguro para identificar
los elementos químicos. Siguiendo el consejo de Kirchhoff observó esas
llamas a través de prismas y los resultados lo condujeron muy pronto al reconocimiento
que las líneas brillantes emitidas por vapores metálicos incandescentes
son independientes de la temperatura así como de los elementos
con los cuales esos metales están combinados ofreciendo características
constantes y fijas de los elementos químicos aunque estén presentes
en cantidades mínimas. Así basta con una cantidad tan pequeña como
un diez millonésimo de miligramo para obtener la doble línea amarilla del Sodio
que delata la presencia de dicho elemento cuando la química analítica no logra
revelar ningún vestigio del elemento.
El
estudio de las líneas de colores emitidas por varios cuerpos, ya sea en la llama
(Bunsen inventó el mechero que lleva su nombre), en el arco voltaico o en
la chispa eléctrica convenció a Bunsen de la seguridad de su método, que fue
confirmado, en 1860 y 1861, con el descubrimiento del Rubidio
y
el Cesio.
Posteriormente, 1861 William Crookes (1832-1919) descubrió el Talio y en 1863 Ferdinand Reich (1799-1882) y Theodor Richter (1824-1898) descubrieron el Indio. El análisis espectral por emisión estaba fundado. Faltaba solamente quien articulara en un corpus coherente la gran cantidad de conocimiento empírico que se encontraba disperso; esta fue la tarea de Kirchhoff.
Producir
artificialmente en el laboratorio las líneas de Fraunhofer fue lo que dio la
clave del problema. Kirchhoff realizó esta hazaña de una manera que, una vez
conocida, parece muy simple. Encendió una intensa llama engendradora de
las dos líneas amarillas del Sodio y en el trayecto colocó una lámpara de alcohol
con una solución de sales de sodio... Instantáneamente las líneas amarillas
y brillantes se convirtieron en las líneas oscuras D, idénticas a las del espectro
solar. Si en lugar de sales de Sodio utilizaba cloruro de Litio, era la línea
roja característica del Litio la que se tornaba oscura.
Reconoció que las llamas coloreadas, fuentes de líneas brillantes, si están colocadas entre una fuente luminosa bastante intensa y el prisma, absorben los rayos de la misma longitud de onda que emite, introduciendo en el espectro rayas negras en su lugar.
“Podemos admitir –escribe Kirchhoff en Octubre de 1859 en su breve comunicación a la Academia de Berlín– que las líneas brillantes del espectro de una llama, que coinciden con las líneas D, se deben siempre al contenido de Sodio de las mismas. Las líneas oscuras D en el espectro solar permiten por lo tanto concluir que se encuentra Sodio en la atmósfera solar”.
Como los gases de la envoltura del Sol son más fríos que el astro, un elemento dado en la atmósfera solar es incapaz de reemplazar con su propia radiación los rayos que ha absorbido. Así nacen las líneas oscuras en el espectro solar como lagunas que se traducen en la ausencia, en la luz, de rayos de elementos presentes en el Sol.
En
el mismo año de 1859 Kirchhoff envía una segunda comunicación a la Academia
de Berlín, generalizando su ley. Introdujo una nueva noción: la de un cuerpo
perfectamente negro, es decir un cuerpo susceptible de absorber totalmente
los rayos de todas las longitudes de onda y no reflejar ninguno. Tal cuerpo
fue sólo una exigencia teórica de Kirchhoff; sin embargo algo más tarde, en
1895, fue realizado técnicamente por Wilhelm Wien (1864–1928) y por
Otto Lummer (1870–1925).
Una vez definido el cuerpo negro Kirchhoff demostró la validez de la proporción e / a = E / A donde e y a son el poder de emisión y de absorción de un cuerpo cualquiera y E y A son esos poderes para un cuerpo negro, de ahí que el segundo miembro de esa proporción es una constante bien determinada, de manera que en los “Anales de la Física” de 1860 Kirchhoff enuncia su ley: para las radiaciones de una misma longitud de onda a la misma temperatura, la razón entre el poder de emisión y el poder de absorción es siempre la misma.
Las leyes de Kirchhoff de la espectroscopía pueden enunciarse de la siguiente manera:
1. Un sólido o un líquido (o un gas muy
denso) incandescente, produce siempre un espectro continuo.
2. Un gas (enrarecido) incandescente
produce un espectro de líneas brillantes de emisión, sin continuo.
3. Un espectro continuo cuando pasa a
través de un gas se transforma en un espectro con líneas oscuras.
4. Las posiciones de las líneas tanto
de emisión como de absorción son características de la constitución
química de la materia que las produce. Cada elemento y cada compuesto tiene sus
líneas características. Los elementos absorben o emiten luz sólo de ciertas
longitudes de onda. En consecuencia el estudio de un espectro permite la
identificación de los elementos químicos que lo produjeron.
Kirchhoff
reunió los resultados de sus investigaciones emprendidas en colaboración
con Bunsen sobre los espectros solares y terrestres, en un célebre
ensayo “Examen acerca del espectro solar y el
espectro de los elementos químicos” de 1861 y del
cual la Academia prusiana preparó una edición
especial al año siguiente, en vista de los alcances excepcionales del mismo.
El ensayo de Kirchhoff elimina definitivamente la antigua hipótesis de Alexander Wilson (1766-1813) y de William
Herschel que
concebían al Sol como
una masa fría y oscura envuelta por gases incandescentes.
Kirchhoff sustituyó esta hipótesis, incompatible con el concepto de equilibrio térmico, por la concepción del Sol como un globo de temperatura elevada cuyas capas externas, de temperatura inferior, son semi-líquidas o gaseosas. En tales capas se encuentran, de acuerdo al análisis espectroscópico, Hierro, Calcio, Magnesio, Sodio y Cromo, en grandes cantidades. Por su parte, afirma Kirchhoff, las manchas solares, lejos de ser huecos o aberturas en la atmósfera del Sol, representarían productos locales de enfriamiento, escorias que flotan en la superficie de la fotósfera solar.
Kirchhoff sustituyó esta hipótesis, incompatible con el concepto de equilibrio térmico, por la concepción del Sol como un globo de temperatura elevada cuyas capas externas, de temperatura inferior, son semi-líquidas o gaseosas. En tales capas se encuentran, de acuerdo al análisis espectroscópico, Hierro, Calcio, Magnesio, Sodio y Cromo, en grandes cantidades. Por su parte, afirma Kirchhoff, las manchas solares, lejos de ser huecos o aberturas en la atmósfera del Sol, representarían productos locales de enfriamiento, escorias que flotan en la superficie de la fotósfera solar.
El
análisis espectral dio nacimiento a toda una nueva rama de la astronomía, cuyo
extraordinario desarrollo en las últimas cuatro décadas del siglo XIX abrió las
puertas a la astrofísica del siglo XX. El descubrimiento de Kirchhoff y Bunsen
convirtió en realidad la posibilidad que el hombre penetrara en el conocimiento
químico de cuerpos a distancias estelares. Esto le pareció increíble
a mucho otros testigos de la época. Kirchhoff en una carta que dirige a su
hermano Otto, en 1859 le cuenta:
“Mi intento, el análisis químico del Sol, parece a muchos muy atrevido. No estoy enojado con un filósofo de la Universidad por haberme contado mientras paseábamos, que un loco pretende haber descubierto Sodio en el Sol. No pude resistir la tentación de revelarle que ese loco era yo”.
“Mi intento, el análisis químico del Sol, parece a muchos muy atrevido. No estoy enojado con un filósofo de la Universidad por haberme contado mientras paseábamos, que un loco pretende haber descubierto Sodio en el Sol. No pude resistir la tentación de revelarle que ese loco era yo”.
La Radiación: una primera
aproximación
En
1859 Kirchhoff introduce la idea del cuerpo negro. Puede tenerse una muy buena
aproximación de un cuerpo negro mediante una cavidad con un orificio muy
pequeño. Las características de la radiación en el interior de dicha cavidad depende
únicamente de la temperatura de sus paredes. A temperaturas ordinarias
(por debajo de unos 600°C) la radiación térmica emitida por un cuerpo
negro no es visible porque la energía se concentra en la región infrarroja
del espectro electromagnético. Al irse calentando el cuerpo, aumenta la
cantidad de energía radiada (de acuerdo con la ley de Stefan- Boltzmann explicada
más adelante) y la concentración de la energía se desplaza hacia las longitudes
de onda más cortas. Entre 600 y 700°C, aparece ya suficiente cantidad
de energía en el espectro visible como para que el cuerpo brille con un
color rojo oscuro. A temperaturas aún más elevadas, se hace rojo brillante, e
incluso “rojo blanco”.
La
figura muestra la potencia radiada por un cuerpo negro en función de la longitud
de onda para tres temperaturas diferentes. Se conocen estas curvas con
el nombre de curvas de distribución espectral. La magnitud P en esta figura es
la potencia radiada por unidad de longitud de onda. Es una función tanto de la
longitud de onda (lambda) como de la temperatura [ T ] y se denomina
función de distribución
espectral. Esta función:
tiene un máximo para una longitud de onda, que varía de forma inversa con la temperatura de acuerdo con la ley de desplazamiento de Wien:
tiene un máximo para una longitud de onda, que varía de forma inversa con la temperatura de acuerdo con la ley de desplazamiento de Wien:
La
función de distribución espectral
P(lambda,T) puede calcularse
de una forma directa
a partir de la termodinámica clásica. Y el resultado obtenido ha de compararse
con las curvas obtenidas experimentalmente. El resultado del cálculo
clásico, conocido como ley de Rayleigh·Jeans, es:
 en donde
k es la constante de Boltzmann. Este
resultado concuerda con los valores
experimentales en la región de longitudes de onda largas. Pero está en total
desacuerdo cuando se trata de las longitudes de onda cortas. Cuando (lambda)
tiende a cero el valor de P(lambda,T) determinado
experimentalmente también tiende
a cero, pero la función calculada se acerca a infinito porque es proporcional
a:
en donde
k es la constante de Boltzmann. Este
resultado concuerda con los valores
experimentales en la región de longitudes de onda largas. Pero está en total
desacuerdo cuando se trata de las longitudes de onda cortas. Cuando (lambda)
tiende a cero el valor de P(lambda,T) determinado
experimentalmente también tiende
a cero, pero la función calculada se acerca a infinito porque es proporcional
a:
Así pues, de acuerdo con el cálculo clásico, los cuerpos negros radian una cantidad infinita de energía concentrada en las longitudes de onda muy cortas.
 en donde
k es la constante de Boltzmann. Este
resultado concuerda con los valores
experimentales en la región de longitudes de onda largas. Pero está en total
desacuerdo cuando se trata de las longitudes de onda cortas. Cuando (lambda)
tiende a cero el valor de P(lambda,T) determinado
experimentalmente también tiende
a cero, pero la función calculada se acerca a infinito porque es proporcional
a:
en donde
k es la constante de Boltzmann. Este
resultado concuerda con los valores
experimentales en la región de longitudes de onda largas. Pero está en total
desacuerdo cuando se trata de las longitudes de onda cortas. Cuando (lambda)
tiende a cero el valor de P(lambda,T) determinado
experimentalmente también tiende
a cero, pero la función calculada se acerca a infinito porque es proporcional
a: Así pues, de acuerdo con el cálculo clásico, los cuerpos negros radian una cantidad infinita de energía concentrada en las longitudes de onda muy cortas.
En 1900, el físico alemán Max Planck (1858 - 1947) anunció que realizando una inusitada modificación en los cálculos clásicos podía deducir una función P(lambda,T) que concordaba con los dalos experimentales para todas las longitudes de onda.
Así, encontró que podía “deducir" esta función si realizaba la sorprendente hipótesis de que la energía emitida y absorbida por el cuerpo negro no era continua sino que, por el contrario, era emitida o absorbida en paquetes discretos o "cuantos".
Planck postuló que el tamaño de "un cuanto de energía" era proporcional a la frecuencia de la radiación: E = hf, en donde h es la constante de proporcionalidad conocida actualmente como constante de Planck.
Él
mismo determinó el valor de h ajustando su función a los datos obtenidos de modo experimental.
El valor aceptado de esta constante se toma ahora como:
La aplicación más famosa de la cuantización de la energía a sistemas microscópicos fue la que llevó a cabo Niels Bohr (1885-1962), quien propuso en 1913 un modelo del átomo de hidrógeno que tuvo un éxito espectacular al calcular las longitudes de onda de las líneas del espectro conocido del hidrógeno y al predecir nuevas líneas (posteriormente halladas experimentalmente) en el espectro infrarrojo y ultravioleta.
La aplicación más famosa de la cuantización de la energía a sistemas microscópicos fue la que llevó a cabo Niels Bohr (1885-1962), quien propuso en 1913 un modelo del átomo de hidrógeno que tuvo un éxito espectacular al calcular las longitudes de onda de las líneas del espectro conocido del hidrógeno y al predecir nuevas líneas (posteriormente halladas experimentalmente) en el espectro infrarrojo y ultravioleta.
Figura 3
Al final del siglo se habían reunido muchos datos sobre la emisión de la luz por los átomos de un gas al ser excitados por una descarga eléctrica. Observada a través de un espectroscopio con una abertura en forma de rendija estrecha, esta luz adquiere el aspecto de una serie discreta de líneas de diferentes colores (cada uno con una freciencia o longitud de onda asociada); la separación e intensidades de las líneas son características de cada elemento.
Fue posible determinar las longitudes de onda de estas líneas con exactitud y se había realizado un gran esfuerzo para encontrar regularidades en los espectros. En 1884. un profesor suizo, Johann Balmer (1825-1898), halló que las longitudes de onda de algunas de las líneas del espectro del hidrógeno pueden representarse por la fórmula:
Figura 5: muestra el conjunto de líneas espectrales del hidrógeno, conocido ahora
como serie de Balmer, cuyas longitudes de onda vienen dadas por esta ecuación.
Balmer sugirió que su fórmula podría ser un caso especial de una expresión más general aplicable a los espectros de otros elementos. Dicha ecuación, encontrada por Johannes R. Rydberg (1854 - 1919) y Walter Ritz (1878-1909), expresa la longitud de onda de la forma siguiente, conocida como fórmula de Rydberg-Ritz:
Esta
fórmula es válida no sólo para el hidrógeno de número atómico Z=1, sino
también para átomos más pesados con carga nuclear Ze-, en los cuales todos
los electrones excepto uno han sido eliminados.
R, denominada constante de Rydberg, o
simplemente Rydberg, es la misma para
todas las series del mismo elemento y varía sólo ligeramente y de modo regular
de un elemento a otro. En el caso de elementos de gran masa R tiende al
valor:
La
fórmula de Rydberg-Ritz y algunas modificaciones de la misma han tenido mucho
éxito a la hora de predecir otros espectros. Por ejemplo, fueron previstas
y encontradas otras líneas del espectro del hidrógeno que caían fuera del
espectro óptico visible. Haciendo n2=1 en la ecuación se obtiene una serie en
la región ultravioleta denominada Serie de Lyman,
mientras
que si se pone n2=3 se obtiene la serie de Paschen, en la región infrarroja.
Espectros de emisión
La
materia que absorbe energía pasa a un estado excitado y vuelve a emitirla para
volver a su estado fundamental, de mínima energía. La materia puede absorber
energía, no solo de la radiación electromagnética, sino de otras formas,
como energía calorífica o eléctrica. Y puede emitirla en forma de energía
calorífica, química, o de muchas formas más. Lo que nos interesa es el
proceso por el cual emite energía en forma de radiación electromagnética.
Observemos
el cambio de coloración que experimenta un clavo de hierro introducido
en el fuego. Primero aparece rojizo, luego amarillento, y, si la temperatura
es muy alta, veríamos que cambia hacia el blanco. Absorbe energía
calorífica y la emiite en forma de radiación electromagnética en la zona del
visible. Introduzcamos una piedra caliza (carbonato cálcico), previamente humedecida
con agua fuerte (acido clorhídrico) en la llama de un mechero. El calcio
emitirá su característico color rojizo. Si introducimos un hilo de cobre, previamente
humedecido con agua fuerte, en la llama, esta se coloreara de un intenso
color azul y verde, claramente diferenciables.
Los
anuncios en letreros luminosos son otro ejemplo: La energía eléctrica excita la sustancia
que hay dentro del tubo luminiscente y ésta emite la energía absorbida
en forma de ondas electromagnéticas.
Cada sustancia emite unas energías características que nosotros detectamos en forma de colores diferentes. Si esta radiación visible la descomponemos a través de un prisma y dejamos que impresione una placa, comprobaremos que se compone de ondas de varias frecuencias. Cada onda impresiona una línea en la placa. Hemos obtenido un espectro de líneas, el espectro de emisión de la sustancia. Y las líneas corresponden a las mismas frecuencias que las de su espectro de absorción. Evidentemente, para volver a su estado fundamental, la sustancia excitada deberá emitir la misma energía que previamente había absorbido.
Cada sustancia emite unas energías características que nosotros detectamos en forma de colores diferentes. Si esta radiación visible la descomponemos a través de un prisma y dejamos que impresione una placa, comprobaremos que se compone de ondas de varias frecuencias. Cada onda impresiona una línea en la placa. Hemos obtenido un espectro de líneas, el espectro de emisión de la sustancia. Y las líneas corresponden a las mismas frecuencias que las de su espectro de absorción. Evidentemente, para volver a su estado fundamental, la sustancia excitada deberá emitir la misma energía que previamente había absorbido.
Las ondas electromagnéticas que emite una sustancia, previamente excitada, ordenadas según su longitud de onda, constituyen su espectro de emisión. El espectro de una sustancia es un espectro de líneas, formado sólo por determinadas longitudes de onda y, por ende, determinadas energías.
Espectros de absorción
Cada sustancia tiene sus propias frecuencias de resonancia a las cuales absorbe energía de la radiación electromagnética. Cuando una onda electromagnética, de cierta frecuencia o longitud de onda, que porta una determinada energía, interactúa con la materia, que es un sistema de cargas, imprime una oscilación forzada sobre el movimiento natural de las cargas.
Podemos
considerar los electrones en un átomo como osciladores que tienen ciertas
frecuencias. Si la frecuencia de la onda que lo perturba es igual a su frecuencia
natural de oscilación, se produce resonancia y el electrón absorbe energía
de la onda electromagnética. Si todo el espectro de la radiación electromagnética
interactúa con la materia, los electrones absorberán las ondas
que lleven una energía, una frecuencia, igual a la frecuencia natural de sus
movimientos de oscilación. Si se recoge el espectro de la radiación sobre una
placa fotográfica, después de haber atravesado la materia una sustancia determinada,
obtendremos las frecuencias de resonancia, es decir, las energías
que la sustancia absorbe y que constituyen el espectro de absorción de
esta sustancia. (las frecuencias de resonancia de absorción no llegan a la placa
y las líneas aparecerán como espacios no impresionados).
Cuando
la radiación electromagnética incide sobre la materia, ésta puede absorber
energía. Las energías que absorbe constituyen, ordenadas según su longitud
de onda, su espectro de absorción. La materia solo absorbe determinadas
energías. El espectro de absorción es característico de cada sustancia
y es un espectro de líneas.
Temperatura y clasificación de las
estrellas
Es posible conocer la temperatura superficial de las estrellas mediante la aplicación de las leyes de radiación, en particular la ley de Planck, antes mencionada, y dos leyes derivadas de ésta: la Ley de Wien y la Ley de Stefan-Boltzmann. El método más utilizado es la ley de Planck, ya que la Ley de Wien presenta dificultades debido al pequeño intervalo de longitudes de onda en el que es posible medir la energía que nos llega de los astros, y la Ley de Stefan y Boltzmann solo es posible emplearla conociendo la distancia y el radio de la estrella. Esta ley nos dice que la energía radiada por unidad de tiempo y superficie es:
Es posible conocer la temperatura superficial de las estrellas mediante la aplicación de las leyes de radiación, en particular la ley de Planck, antes mencionada, y dos leyes derivadas de ésta: la Ley de Wien y la Ley de Stefan-Boltzmann. El método más utilizado es la ley de Planck, ya que la Ley de Wien presenta dificultades debido al pequeño intervalo de longitudes de onda en el que es posible medir la energía que nos llega de los astros, y la Ley de Stefan y Boltzmann solo es posible emplearla conociendo la distancia y el radio de la estrella. Esta ley nos dice que la energía radiada por unidad de tiempo y superficie es:
y
c es la velocidad de la luz en el vacío: 299.792.458 m/s.
Si suponemos que las estrellas emiten radiación como un cuerpo negro, podemos definir a la luminosidad como:
Y midiendo el brillo de una estrella, así como conociendo su distancia:
A los fines prácticos, ajustar la curva de Planck a la energía obtenida por longitud de onda, nos permite determinar aproximadamente la temperatura de la estrella. En base a esta determinación Edward Charles Pickering (1846 - 1919), de la Universidad de Harvard, realizó en el año 1890 una clasificación de las estrellas teniendo en cuenta sus espectros y su temperatura superficial.
Tipos espectrales clásicos:
* Clase O: son estrellas muy calientes y luminosas destacando en brillantes colores azules. Naos (en la constelación de Puppis) brilla con una potencia cercana a un millón de veces superior a la del Sol. Estas estrellas tienen líneas de helio ionizado y neutro muy prominentes y presentan líneas débiles de Balmer de hidrógeno. Emiten la mayor parte de su radiación en el ultravioleta.
*
Clase B: extremadamente luminosas, como Rigel en Orión, una supergigante
azul. Los espectros de estas estrellas tienen líneas de helio neutral
y líneas moderadas de hidrógeno. Como las estrellas O y B tienen tanta masa
consumen su energía mucho más deprisa que otras estrellas más pequeñas
liberando cantidades inmensas de energía y viviendo durante un
corto
periodo de tiempo de unos millones de años. En este tiempo no pueden alejarse
demasiado de las regiones de formación estelar en las que nacen por lo
que suelen presentarse en grupos de varias estrellas en lo que se conoce como
asociaciones OB1, formadas en el interior de nubes moleculares gigantes.
La asociación OB1 de Orión es el ejemplo más cercano.
*
Clase A: son las estrellas más comunes que observamos a simple vista. Deneb
en el Cisne es una estrella de gran brillo mientras que Sirio, la estrella más
brillante desde la Tierra es también una estrella de tipo A muy cercana pero
no tan grande como Deneb. Las estrellas de clase A tienen pronunciadas líneas
de Balmer de hidrógeno y poseen también líneas de metales ionizados.
*
Clase F: siguen siendo estrellas de gran masa y muy brillantes pero pertenecen
ya a la secuencia principal. Como ejemplo podemos considerar Fomalhaut
en Piscis Australis. Sus espectros se caracterizan por líneas de Balmer
de hidrógeno débiles y metales ionizados. Son de color blanco con un ligero
componente amarillo.
*
Clase G: son las mejor conocidas ya que nuestro Sol pertenece a esta clase
siendo una estrella de tipo G2. Tienen líneas de hidrógeno aún más débiles
que las F y cuentan con líneas de metales ionizados y neutros.
* Clase K: estrellas naranja algo más frías que el Sol. Algunas de ellas son gigantes e incluso supergigantes como Antares, mientras que otras estrellas K como Alpha Centauri B pertenecen a la secuencia principal. Tienen líneas de hidrógeno muy débiles y en ocasiones algunas líneas correspondientes a metales neutros.
*
Clase M: es la más común de todas por el número de estrellas. Todas las enanas
rojas pertenecen a esta clase y más del 90% de todas las estrellas son de
este tipo como Próxima Centauri. La clase M también corresponde a la mayoría
de las gigantes y a algunas supergigantes como Arcturus y Betelgeuse,
así como a las variables Mira. El espectro de una estrella M tiene líneas
moléculas y de metales neutros pero normalmente no muestra líneas de hidrógeno.
El óxido de Titanio puede formar líneas intensas en las estrellas M.
Nuevos tipos espectrales:
Nuevos tipos espectrales:
Más recientemente la clasificación ha sido extendida con nuevos tipos espectrales resultando en la secuencia W O B A F G K M L T y R N C S donde W son estrellas de Wolf-Rayet, L y T representan estrellas extremadamente frías y de poca masa del tipo de las enanas marrones y R, N, C y S que son utilizadas para clasificar estrellas ricas en carbono.
*
W: más de 70.000 K - Estrellas de Wolf-Rayet. Estas estrellas superluminosas
son muy distintas a otros tipos estelares por mostrar grandes cantidades
de helio. Se considera que son grandes supergigantes en el final de sus
vidas con su capa de hidrógeno exterior expulsada por el fuerte viento estelar
causado a tan altas temperaturas. Por este motivo dejan expuesto su núcleo
rico en helio.
*
L: 1500 - 2000 K - Estrellas con masa insuficiente para desarrollar reacciones
nucleares. Son enanas marrones, estrellas de poca masa incapaces
de producir reacciones termonucleares de hidrógeno y que conservan
intacto el litio que es destruido por reacciones termonucleares en estrellas
mayores (L proviene de hecho del litio presente en estas estrellas). Estas
estrellas son tan frías que emiten en el infrarrojo cercano.
*
T: 1000 K - Se trata de estrellas T Tauri, muy jóvenes y de baja masa, algunas
a temperaturas tan frías como 600 K. Se trata muy probablemente de estrellas
de baja masa en proceso de formación y suelen estar rodeadas de discos
de acreción.
*
C: estrellas de carbono. Se subdividen en los siguientes tipos: R, N y S. Se trata
de gigantes rojas en el final de sus vidas.
*
D: enanas blancas, por ejemplo Sirio B. La mayoría de las estrellas terminan
sus vidas perteneciendo a este tipo.
Temperatura de color
 El
color asociado a cada estrella se basa en los colores asociados a las longitudes
de onda donde la curva de Planck tiene el máximo de energía para cada
temperatura. La Ley de Wien nos proporciona la longitud de onda que corresponde
al valor máximo, sin embargo dependiendo de dónde se ubique el máximo,
será el color con el que percibiremos la estrella.
El
color asociado a cada estrella se basa en los colores asociados a las longitudes
de onda donde la curva de Planck tiene el máximo de energía para cada
temperatura. La Ley de Wien nos proporciona la longitud de onda que corresponde
al valor máximo, sin embargo dependiendo de dónde se ubique el máximo,
será el color con el que percibiremos la estrella. El siguiente gráfico de la energía en función de la longitud de onda sirve como ejemplo. En el primer gráfico la estrella se nos presenta rojiza, ya que el máximo de energía se encuentra cercano a la longitud de onda que corresponde al rojo. En el segundo gráfico, la estrella la veremos de color blanco-amarillenta, ya que los valores máximos cubren todo el espectro visible. En el tercer gráfico, la estrella será vista en un color blanco-azulado.
Distancias estelares
El
método clásico de medir la distancia a una estrella es el cálculo de su paralaje,
lo que equivale a hallar geométricamente el ángulo, en segundos de arco,
en el que cabe el radio de la órbita de la Tierra alrededor del Sol, visto desde
el astro. Este método tiene sentido práctico para distancias menores a 20
pársec (2” o 65 años luz) ya que a mayores distancias, el error se vuelve significativamente
grande. Se ha hallado un método para medir distancias mayores
a 20 pársec, con mayor precisión, basado en las magnitudes luminosas
de las estrellas.
Figura: 7.
Figura: 7.
En el año 120 a.c. el astrónomo griego Hiparco compiló un catálogo de aproximadamente un millar de estrellas identificándolas por su brillo relativo. Utilizó una escala de seis magnitudes asignándoles magnitud 1 a las más brillantes y 6 a las menos brillantes. Este catálogo fue perfeccionándose y ampliándose con el tiempo hasta observar estrellas muy débiles de magnitud 27. En 1830 el astrónomo inglés John Herschel (1792-1871) encontró la relación de intensidades correspondientes a una diferencia de magnitud, sabiendo que una estrella de magnitud 1 es 100 veces más brillante que una de magnitud 6. Es decir:
Sin
embargo lo que observamos como magnitudes de las estrellas se corresponde
con el brillo aparente que ellas tienen vistas desde la Tierra, pero éstos
no son los brillos reales, ya que están ubicadas a diferentes distancias. Para
poder comparar sus brillos intrínsecos debemos conocer estas distancias y,
dados estos valores, definimos las Magnitudes
Absolutas.
 Se
define como magnitud absoluta de una estrella (M) a la magnitud
que esta tendría
si estuviera situada a una distancia de 10 pársec de la Tierra (ó 0,1” de paralaje).
De esta manera, al ubicar a todas las estrellas a la misma distancia, podemos
comparar sus brillos entre sí.
Se
define como magnitud absoluta de una estrella (M) a la magnitud
que esta tendría
si estuviera situada a una distancia de 10 pársec de la Tierra (ó 0,1” de paralaje).
De esta manera, al ubicar a todas las estrellas a la misma distancia, podemos
comparar sus brillos entre sí.
Donde
d es la distancia de la estrella.
Velocidad
El movimiento de las estrellas se realiza en tres dimensiones. El llamado movimiento propio es perpendicular a la visual, con el cual puede determinarse la velocidad tangencial de la estrella, si se conoce la distancia a la que se encuentra la estrella, y además, si se acercan o se alejan del observador, desplazamientos que se miden a través de la denominada velocidad radial.
El
desplazamiento total de una estrella se calcula sobre la base de sus velocidades
radial (Vr) y tangencial (Vt), componiendo
ambas mediante la regla del
paralelogramo. La composición de dichas velocidades se conoce como velocidad
espacial de la estrella (Ve) y se expresa como:
Ve 2 = Vr 2 + Vt 2
La Ve que resulta, es la velocidad espacial relativa de la estrella con respecto al observador; para obtener la velocidad absoluta se debe restar la velocidad del observador.
La dirección del movimiento de la estrella se deduce geométricamente de la razón entre sus velocidades radial y tangencial; puede estimarse además por el ángulo que forma la velocidad espacial con la dirección de la visual.
La velocidad radial es la componente de la velocidad de la estrella en el sentido de la visual dirigida a la misma. Sirio, la estrella más brillante del cielo tiene una velocidad radial de -8 km/seg.
La
medición de las velocidades radiales se realiza mediante el análisis del espectro
de las estrellas; las líneas espectrales de los elementos de la serie periódica
que aparecen en él se desplazan hacia el azul o hacia el rojo según que
la fuente luminosa se acerque o se aleje del observador. Este fenómenos es
denominado efecto Doppler de la luz.
Por otra parte, ese desplazamiento de las líneas en el espectro es proporcional a la velocidad de la fuente, lo cual permite determinar la velocidad radial de una estrella midiendo el corrimiento de las líneas de su respectivo espectro. La medida se reduce a obtener el espectro de la estrella superpuesto a un espectro de comparación de una fuente terrestre. Si en el espectro estelar se mide el desplazamiento, mediante la expresión del efecto Doppler encontramos que la velocidad radial es igual al producto de la velocidad de la luz c multiplicada por el desplazamiento de la longitud de onda de esa misma línea con respecto a la posición normal de la línea en un espectro de referencia
determinado
en un laboratorio terrestre.
Figura: 8
Gráfico del corrimiento espectral debido a la velocidad. En primer lugar vemos un par de líneas espectrales del Sol. En segundo lugar, las mismas líneas, corridas hacia el rojo, en una galaxia que se aleja rápidamente de nosotros. En tercer lugar, las mismas líneas, aún más corridas, en una galaxia que se aleja más rápidamente.
Rotación
En una estrella en rotación, si tomamos un diámetro, sobre su disco aparente, que resulte perpendicular al eje de rotación de la estrella, podremos observar, en los puntos opuestos del diámetro, diferentes velocidades radiales, ya que un punto se aleja de nosotros mientras el otro se acerca. Este fenómeno es detectable debido al efecto Doppler producido en la luz que nos llega de cada punto.
Desde el punto que se acerca a nosotros, su luz nos llega ligeramente desplazada hacia el violeta (menor longitud de onda), mientras que desde el punto que se aleja recibimos su luz desplazada hacia el rojo (mayor longitud de onda).
Como la mayoría de las estrellas se nos aparecen como puntos luminosos, en la luz que nos llega de ellas está contenida toda la información junta de todos los fenómenos que se dan en el astro en un instante de tiempo. Sin embargo es posible detectar el efecto Doppler producido por la rotación en las líneas espectrales. Al recibir simultáneamente el corrimiento hacia el violeta y hacia el rojo, en el espectro observamos la suma de estos efectos, por lo que las líneas se nos aparecen ensanchadas.
Figura: 9
Si la estrella rota rápidamente, las líneas aparecerán notablemente ensanchadas, y poco ensanchadas si la velocidad de rotación es menor.
Aplicando
este procedimientos a miles de estrellas se han podido obtener velocidades
de rotación de 100 km/s a 250 km/s para estrella azuladas, de unos
pocos kilómetros por segundo para estrellas amarillas (como el Sol) y de muy
baja velocidad de rotación para estrellas rojas.
Figura: 10.
Gráfico de ensanchamiento rotacional (velocidad ecuatorial de 1,2,5,10,20 o 40 km/s). Debido a la conservación de la energía se produce una disminución de la profundidad de la línea cuando la velocidad rotacional aumenta.
Composición química superficial
La radiación que corresponde al espectro continuo se produce desde la fotósfera de la estrella. Por encima de la fotósfera se halla una zona de menor temperatura donde se origina una serie de líneas oscuras o de absorción. El hecho de encontrar líneas oscuras en el espectro es indicativo de que el gas de la superficie estelar se encuentra más frío que el de las capas más profundas, dando lugar a que los átomos absorban la energía que proviene del interior de la estrella antes de llegar a nosotros.
El
análisis de estos espectros, en su mayoría de absorción, permite estimar la composición
química de las estrellas. En laboratorios terrestres se verifica que cada
átomo o molécula define un patrón bien determinado de líneas espectrales,
Estas series se ubican en posiciones fijas y diferentes (en cuanto a
longitud de onda) para cada elemento. Obtenido un espectro, se puede identificar,
sin ambigüedad, los componentes químicos de la estrella, mediante la
inspección de la posición de las líneas presentes, en comparación con las obtenidas
en los laboratorios terrestres.
Diferentes
líneas espectrales en distintas estrellas sugieren, en principio, diferencias
en sus composiciones químicas. Sin embargo se puede comprobar que
la gran variedad de espectros estelares se debe a diferencias en temperaturas,
presión y densidad, más que de composición.
En una estrella de grandes dimensiones la atmósfera se encuentra más extendida y resulta menos densa que en otra de tamaño menor. En estas condiciones, los átomos ionizados de una estrella tienen menor probabilidad de adquirir electrones libres que en otra más densa y, por lo tanto, de pasar al estado neutro. En estas estrellas de grandes dimensiones, las líneas que corresponden a átomos ionizados son más intensas que las mismas líneas en estrellas más pequeñas, donde la presión del gas es mayor. Estas líneas sirven entonces como indicadores del tamaño de la estrella.
En una estrella de grandes dimensiones la atmósfera se encuentra más extendida y resulta menos densa que en otra de tamaño menor. En estas condiciones, los átomos ionizados de una estrella tienen menor probabilidad de adquirir electrones libres que en otra más densa y, por lo tanto, de pasar al estado neutro. En estas estrellas de grandes dimensiones, las líneas que corresponden a átomos ionizados son más intensas que las mismas líneas en estrellas más pequeñas, donde la presión del gas es mayor. Estas líneas sirven entonces como indicadores del tamaño de la estrella.
Respecto
a la abundancia de los diferentes elementos, se ha podido comprobar que
todas las estrellas tienen aproximadamente la misma. Las líneas preponderantes
en los espectros estelares corresponden al elemento hidrógeno,
pero no siempre están presentes, ya que en las atmósferas de estrellas
de muy altas temperaturas, el hidrógeno se encuentra ionizado y no aparecen
líneas de absorción de ese elemento; en las de muy bajas temperaturas,
la mayoría de los elementos atmosféricos están en estado neutro y
se aprecian abundantes líneas de absorción, que ocultan las correspondientes
al hidrógeno.
Bibliografía
Mieli, Bruno. “Panorama General de Historia de la Ciencia”. Tomo VII. Ed. Espasa-Calpe. Buenos Aires, octubre de 1958.
Jaschek, Carlos - Corvalán de Jaschek, Mercedes. “Astrofísica”. Secretaría General de la Organización de los Estados Americanos. Programa Regional de Desarrollo Científico y Tecnológico. Washington DC, 1983 (primera edición 1974).
Estella Escudero, Juana. "Espectros. Una aproximación experimental al estudio mecanocuántico del átomo y de la estructura de la materia". Revista Maina, 1982, Núm. 6, p. 4-11.
Feinstein, Alejandro - Tignanelli, Horacio. “Objetivo Universo”. Editorial Colihue. Buenos Aires, 1999.
Tipler, Paul. Física (tercera edición) Vol II. Cap 35. Editorial Reverté. Barcelona, 1993.
















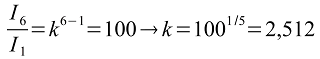




Muy interesante, esta tecnología fue realemnte la emisaria de la humanidad en el cosmos; la que nos permitió saber "de que están hechas las estrellas"; es la tecnología que "está allá por nosotros".
ResponderEliminarClaudio Sobico, carrera de Educación en Tecnología.
¡ Qué interesante tu punto de vista !
ResponderEliminarYo siempre lo vi como una tecnología de "traer las estrellas acá, para nosotros..."